Em reunião da Diretoria Colegiada nesta terça-feira (9/2), a Agência Nacional de Vigilância Sanitária (Anvisa) decidiu que as vacinas compradas por meio da Covax Facility não vão precisar de registro ou autorização emergencial do órgão regulador brasileiro.
Pelas regras, a agência precisa analisar quaisquer imunizantes que não tenham autorização para uso no país. A exceção só vale para as vacinas adquiridas pelo consórcio internacional, capitaneado pela Organização Mundial da Saúde (OMS).
A previsão é de que o Brasil comece a receber 10,7 milhões de doses de vacinas da Covax Facility a partir de fevereiro. A OMS vem fechando acordos com desenvolvedores de vários imunizantes e já aprovou para uso emergencial as doses da Pfizer e da AstraZeneca/Oxford. A princípio, o Brasil receberá apenas doses da AstraZeneca, que já teve 2 milhões de doses liberadas para uso emergencial no país e pediu o registro completo da fórmula na sexta (29/1).
“A iniciativa irá simplificar os processos, de modo a garantir que as vacinas sejam disponibilizadas com qualidade, segurança e eficácia à população brasileira, no menor tempo possível”, afirma a Anvisa, em nota.
De acordo com o texto, a dispensa da análise pela Anvisa é possível porque o consórcio internacional já faz uma avaliação e, entre os responsáveis pela decisão, estão especialistas do órgão regulador.
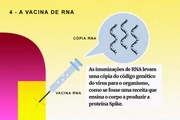
Veja, na galeria, como cada tipo de vacina funciona: